第4世代代謝性腫瘍免疫治療薬GI-108、来年上半期にIND申請
株式会社GIイノベーション革新的新薬開発会社(代表取締役イ・ビョンゴン、ホン・ジュンホ)は17日、日本でのGI-301アレルギー治療薬のL/O交渉が、日本での目標達成を目標に計画通り進んでいると発表した。年の終わり。
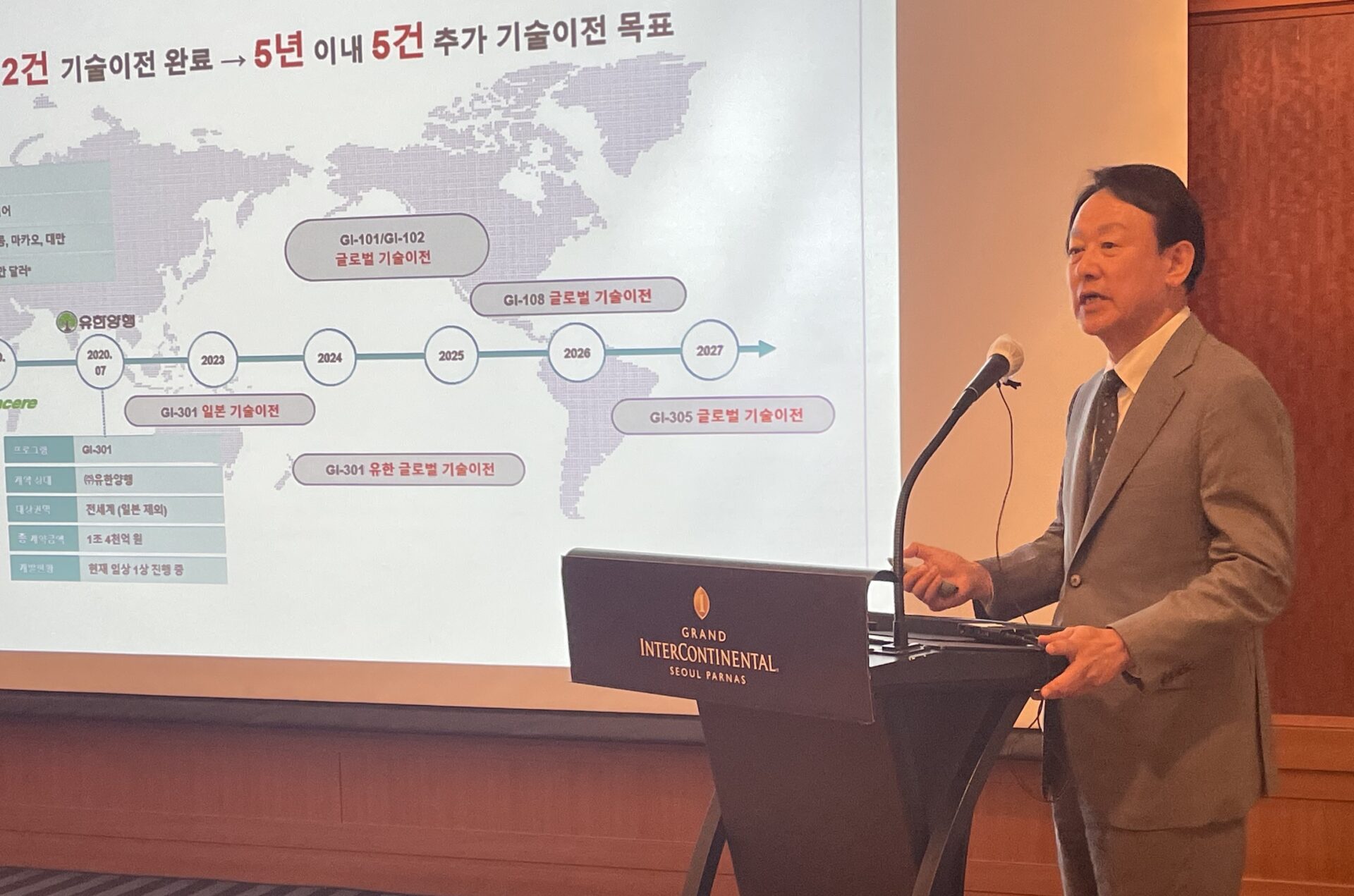
GIイノベーションは17日に記者会見を開き、主なパイプライン開発の進捗状況とGI-301の技術移転に向けた日本の製薬会社3社との協議について説明した。 完成するだろうと説明した。
アレルギー治療薬「GI-301」は、GIイノベーションが2020年7月に1兆4000億ウォン規模(日本を除く全世界著作権)で技術譲渡した物質で、現在韓国で第1b相臨床試験が行われている。
日本は花粉症が1兆ウォン、喘息と慢性閉塞性肺疾患(COPD)が3兆ウォン、アトピー性皮膚炎が4000億ウォンと、アレルギー疾患の主要市場とみなされている。
これに対し、GIイノベーションのイ・ビョンゴン社長は「GI-301の臨床試験は順調に進んでおり、臨床成績は競合薬よりも優れている。日本市場参入に向けて最善を尽くしたい」と述べた。 。
GIイノベーションは会合で、腫瘍免疫薬であるGI-101および102の世界的な臨床試験を加速していると述べた。
「CD80」と「IL-2」変異体の機能を持つ二重融合タンパク質であるGI-101は、現在第1/2相臨床試験が行われており、これまでに1件の完全奏効(CR)と3件の部分奏効(PR)が得られている。単剤療法で報告されています。 提案された結果が得られました。 単剤療法のみでも免疫がん剤耐性患者に効果が認められ、免疫がん剤耐性を克服できる可能性が示唆された。
この新しい製造プロセスにおけるGI-101は、シアル酸含有量の増加、タンパク質の老化の遅延、半減期の延長、効力の維持による薬物動態と薬力学の改善を特徴としていると同社は説明した。
GI-102は現在、韓国で臨床試験を開始しており、米国でも臨床試験に入ろうとしており、米国のニュース週刊誌「ニューズウィーク」が選ぶ2023年世界最高の病院に2つの病院がランクインしている。
さらに、GIイノベーションは、新しいパイプラインである代謝性腫瘍免疫治療薬であるGI-108のINDを来年上半期に申請する予定である。 GI-108は、第4世代抗がん中和抗体「CD73」と免疫賦活剤を結合させたファーストインクラスの二重融合タンパク質です。 CD73過剰発現がんを標的とし、同時に腫瘍微小環境において免疫抑制性代謝物質であるアデノシンを産生することを阻害することで、アデノシンによるT細胞やNK細胞の活性抑制を回復できるといわれています。
「国家新薬開発事業(KDDF)に選定されたGI-108は、サムスンバイオロジクスとの提携を通じて臨床原薬の生産をすでに完了しており、上半期にはIND申請が可能となる。 GIイノベーションの仲介戦略本部長のコ・ヨンジュン氏は「来年には臨床開発会社メディラマと論文承認戦略を確立し、特定のがんを対象とした専門的な国際臨床試験を実施する計画だ」と述べた。 みんな」と彼は言った。

「インターネット狂信者。邪悪な主催者。テレビ狂信者。探検家。流行に敏感なソーシャルメディア中毒者。認定食品専門家。」



![[카드뉴스] 日本の電気機器技術を超えた韓国電気機器規格(KEC)を国際標準へ!](https://www.hellot.net/data/photos/image/thumbnail_1574324707.PNG)

